Comme expliqué précédemment, les fondements de l’économie homéostatique se basent en partie sur la thermodynamique. Dans la nature, nous pouvons distinguer plusieurs types de systèmes qui ont chacun leurs propres particularités.
Tout d’abord, il faut préciser que ce qui défini un système thermodynamique n’est pas obligatoirement une frontière fixe. Un système peut juste être un seul « objet » en interaction avec son environnement ou plusieurs objets distincts interagissant les uns avec les autres et avec leur environnement. Par exemple, un moteur de voiture est un système thermodynamique, un être vivant aussi, mais nous pouvons également considérer un groupe d’êtres vivants, la vapeur d’eau d’une casserole bouillante ou encore un système stellaire comme autant de systèmes thermodynamiques différents. Ce qui caractérise la nature du système concerne essentiellement les échanges de matière et d’énergie qu’il effectue avec son environnement. Il existe trois types de systèmes thermodynamiques.
Les systèmes isolés
Ce sont les plus avares en échanges. En effet, un système isolé est en théorie un système qui n’échange ni matière, ni énergie avec son environnement. Il s’agit en quelque sorte d’un système totalement hermétique. En théorie, un système véritablement isolé n’interagit pas avec son environnement, il n’agit sur rien d’autre que lui même et rien d’extérieur ne peut agir sur lui.
D’après les connaissances scientifiques actuelles, le seul cas de figure qui pourrait hypothétiquement être défini comme un système isolé, serait l’Univers. C’est le seul, car il n’existe pas dans la nature de système véritablement isolé.
La particularité des systèmes isolés, à cause justement de leur isolement, c’est qu’ils ne peuvent qu’augmenter leur niveau global d’entropie dans le temps. Ce qui signifie que l’énergie de ces systèmes ne pourra que se dégrader dans le temps. Nous reviendrons sur cette notion d’entropie dans l’article suivant.
Les systèmes fermés
Contrairement aux systèmes isolés qui n’échangent ni matière, ni énergie avec leur environnement, les systèmes fermés eux, échangent de l’énergie avec leur environnement, mais pas de matière. Par exemple, une bouteille en verre totalement hermétique avec à l’intérieur des végétaux est un système fermé. Il existe très peu d’exemple de systèmes fermés dans la nature car ils nécessitent une clôture parfaite avec le milieu extérieur. En considérant l’être humain et ses constructions comme faisant partie intégrante de la « nature », la plupart des exemples de systèmes fermés sont l’œuvre des humains. Nous pouvons citer l’exemple de stations expérimentales dédiées au spatial qui essaient d’évaluer le degré d’autonomie atteignable dans de futures bases habitées ou vaisseaux spatiaux autonomes.
Une des particularités des systèmes fermés est qu’ils n’arrivent que difficilement à faire vivre de grands animaux sur de longues périodes à cause notamment de la taille restreinte de ces systèmes et du manque de matière qui, à un moment ou un autre, créé d’indéniables manques. A l’heure actuelle, aucun système fermé fabriqué par notre espèce n’a réussi à faire survivre de grands animaux sur des périodes dépassant quelques années.
Les systèmes ouverts
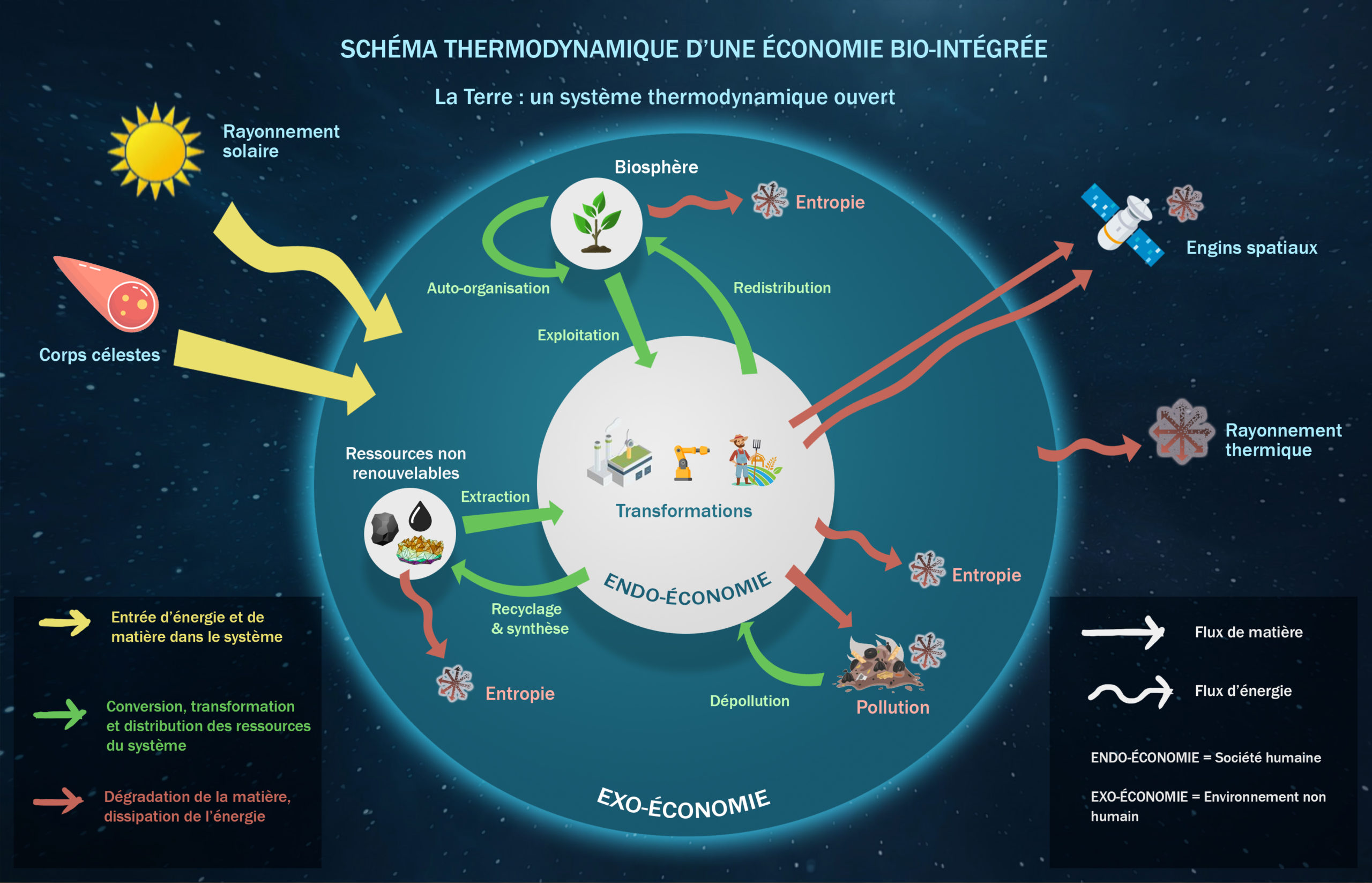
Les systèmes ouverts sont donc les systèmes thermodynamiques les plus communs dans la nature. Ces systèmes permettent un échange de matière et d’énergie avec leur environnement. La Terre est par exemple, un système ouvert. L’énergie électromagnétique de notre soleil, ainsi que bien d’autres formes d’énergies nous parviennent en permettant au vivant de se développer et les objets célestes tels les météorites apportent de la matière sur Terre.
Les êtres vivants, tributaires de l’énergie et de la matière pour leur survie, évoluent plus aisément dans des systèmes thermodynamiques ouverts. En effet, la vie a besoin d’un apport constant d’énergie et de matière pour maintenir son auto-organisation (on parle de systèmes hors équilibre thermodynamique), sans cela l’entropie empêcherait le Vivant de se maintenir en vie.